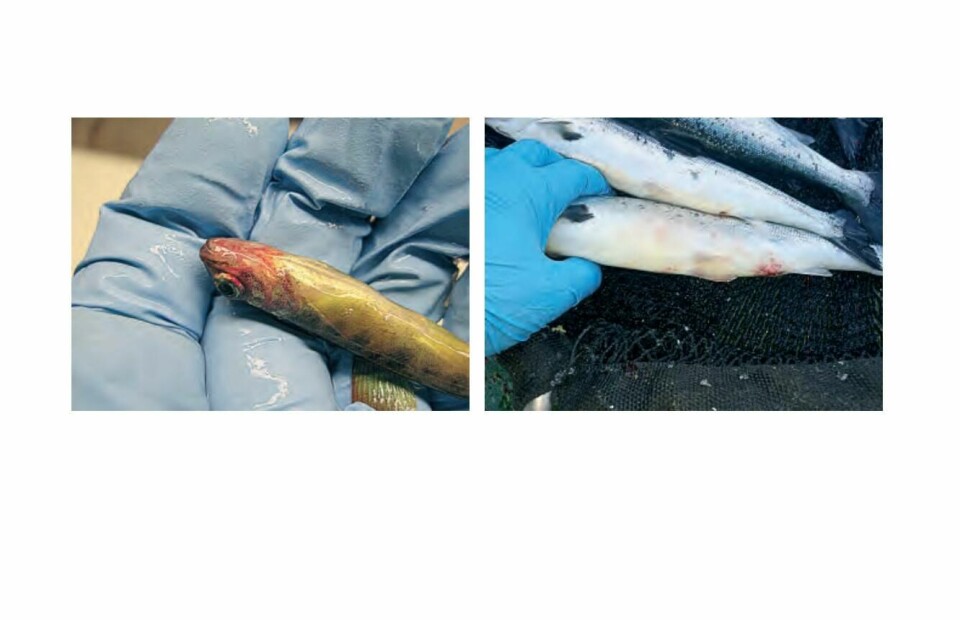
Kunnskapsstatus rundt Yersiniose i norsk lakseoppdrett
Kunnskapen om yersiniose hos laks i Norge økte betraktelig etter at Veterinærinstituttet i 2016-2017 gjennomførte et FHF-finansiert prosjekt knyttet til sykdommen. Her oppsummerer vi resultatene som kaster nytt lys over yersiniose-situasjonen både i Norge og internasjonalt. Kunnskapen gir grunnlag for målrettet bekjempelse av sykdommen hos norsk laks.
Denne artikkelen er tre år eller eldre.
- Yersiniose skyldes infeksjon med den gram-negative bakterien Yersinia ruckeri. Internasjonalt forårsaker yersiniose økt dødelighet hos laksefisk, særlig regnbueørret. I Norge er bakterien kun forbundet med sykdom hos atlantisk laks, med unntak av noen få tilfeller hos oppdrettsrøye. Sykdomsutbrudd i Norge har i all hovedsak vært assosiert med Y. ruckeri serotype O1, og i langt mindre grad serotype O2.
Artikkelen er hentet fra Norsk Fiskeoppdrett nr 3. Les artikkelen i bladet her.
Erfaringer fra næring og diagnostikk tilsier at serotype O2 er mindre virulent enn serotype O1. Man antar at affisert fisk hovedsakelig smittes i ferskvann, men sykdomsutbrudd forekommer både i settefiskfasen og etter sjøsetting. Det var forholdsvis store problemer med yersiniose hos norsk oppdrettslaks mot slutten av 80-tallet og tidlig på 90-tallet.
Etter dette har gjentatte utbrudd av yersiniose vært begrenset til noen få norske settefiskanlegg. Over flere år har det imidlertid igjen vært en gradvis økning i antall påviste tilfeller, og i de siste årene har det vært en betydelig økning i antall utbrudd i resirkuleringsanlegg (RAS) for settefiskproduksjon og hos laks i sjø, særlig i Midt-Norge (Figur 1 og 2).
Man blir stadig mer avhengig av molekylærbiologiske teknikker som PCR, for å påvise sykdomsfremkallende mikroorganismer hos fisk. Utvikling av et diagnostisk PCR-verktøy til serotype-spesifikk påvisning av Y. ruckeri var derfor en prioritert oppgave i prosjektet. Vi sammenlignet hele arvestoffet (genomet) fra en samling av ca. 60 Y. ruckeri stammer fra Norge, Nord- og Sør-Amerika, Europa, Australia og Asia, og fant områder som var unike for hver av serotypene O1 og O2. Med denne kunnskapen kunne vi utvikle en spesifikk qPCR for hver av de to serotypene.
Forekomst av Y. ruckeri i norske ferskvannsanlegg for laks
Sykdomsrelaterte isolater av Y. ruckeri er sterkt overrepresentert i Veterinærinstituttets bakteriesamling. Før prosjektet ble satt i gang visste vi lite om utbredelsen av antatt ikke-virulente stammer i norsk akvakultur. De spesifikke qPCR-ene som ble utviklet mot Y. ruckeri serotype O1 og O2, samt en artsspesifikk qPCR (Patogen AS), ble derfor benyttet til å undersøke forekomsten av Y. ruckeri serotype O1 og O2 i norske ferskvannsanlegg for laks. Både fiskevev og biofilm (karvegg, slam, rør osv.) ble undersøkt.
Ved screening av 24 geografisk spredte ferskvannanlegg (Figur 3) ble Y. ruckeri identifisert i ti anlegg (ca. 40 %). På ni av anleggene ble serotype O1 påvist, mens serotype O2 kun ble påvist på ett anlegg. Y. ruckeri ble identifisert i biofilm i alle de ti anleggene, mens for to av disse ble bakterien også påvist i nyre og tarm hos noen få fisk. Prøvene fra biofilm ble tatt vha. svaber fra et begrenset område, noe som tilsier at den overraskende høye forekomsten sannsynligvis representerer et underestimat.
Ingen av de undersøkte anleggene hadde hatt utbrudd av yersiniose de siste 10 årene. MLVA-analyse (beskrives senere) av Y. ruckeri serotype O1 dyrket fra biofilm i to av anleggene, plasserte disse bakteriene utenfor gruppen av isolater vi senere identifiserte som særlig virulente. Denne manglende assosiasjonen mellom påvisning av Y. ruckeri og tidligere yersiniose-utbrudd tyder på utbredt tilstedeværelse av mindre virulente eller ikke-virulente miljøstammer av serotype O1 i norske ferskvannsanlegg.
Den spesifikke qPCR-analysen for påvisning av serotype O1 som ble utviklet tidlig i prosjektet, skiller ikke mellom virulente stammer og miljøstammer av serotype O1. Vi jobber derfor videre med å utvikle en spesifikk qPCR som kun påviser den norske virulente laksevarianten av Y. ruckeri serotype O1.
Teksten fortsetter under bildet.
Genetisk sammenligning av Y. ruckeri stammer
‘Multi-Locus Variable number of tandem repeat Analysis’, eller MLVA, ble utviklet og benyttet til genetisk typing av nesten 500 Y. ruckeri isolater. Isolatene hadde 17 forskjellige opphav (fiskearter, dyr, miljø) fra 19 land (fordelt på 4 kontinenter), og var isolert i perioden 1959-2017. MLVA-analysen skiller bakteriestammene fra hverandre basert på genetiske ulikheter i ti variable områder spredt utover bakteriens genom. Dette resulterer i at hvert isolat får et 10-talls «MLVA-fingeravtrykk» (MLVA-profil).
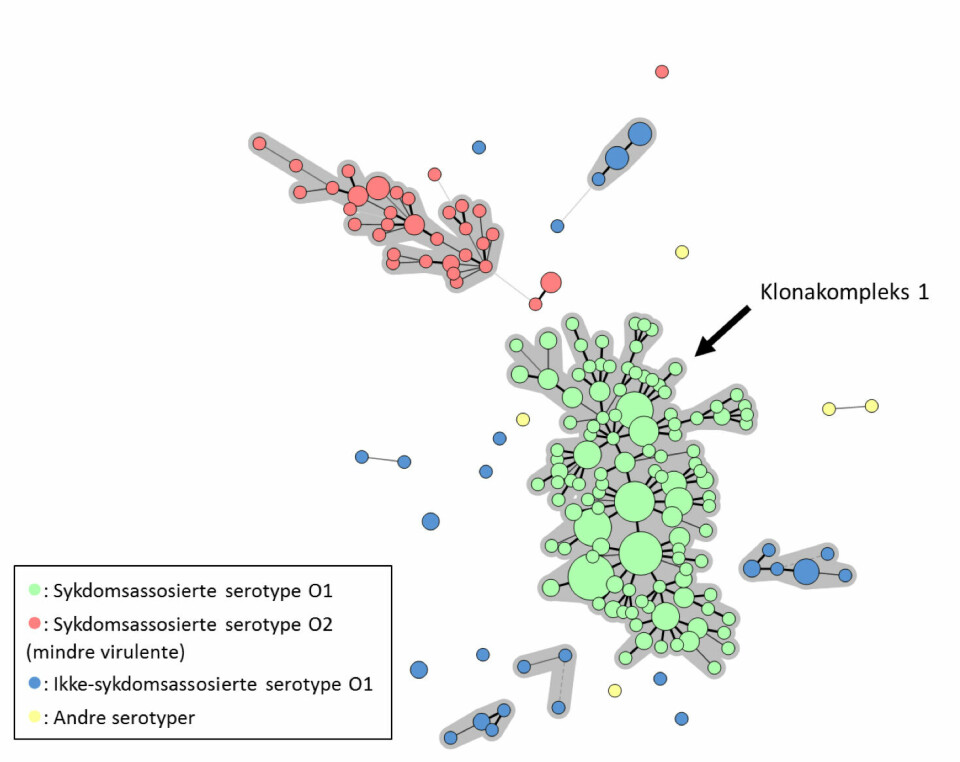
Tilsvarende teknologi brukes også bl.a. innen human rettsmedisin. Graden av likhet mellom ulike MLVA-profiler kan så synliggjøres i et ‘Minimum Spanning Tree’ (MST), som gir en visuelt intuitiv presentasjon av slektskapet mellom isolatene (Figur 4, norske isolater). Isolater med identiske MLVA-profiler inkluderes i samme ‘node’, mens ‘noder’ med forskjellige grader av variasjon mellom profilene kobles sammen gjennom forgreininger av forskjellig tykkelse - jo tykkere forgreining, jo nærmere slektskap. For svært ulike MLVA-profiler vises ingen forgreining, og stammer uten noen nære slektninger i materialet står derfor alene eller uten tilknytning til andre stammer.

Denne omfattende MLVA-analysen av et verdensomspennende utvalg isolater har belyst den underliggende populasjonsstrukturen hos Y. ruckeri både i Norge og internasjonalt. Nært beslektede isolater fordelte seg primært på seks hovedklynger (såkalte klonalkomplekser). Tydelige epidemiologiske mønstre kunne observeres basert på vertsopphav, serotype og geografi. Figur 5 viser hvordan ulike serotyper fordeler seg i klonalkomplekser.
Resultatene fra MLVA viser et klart skille mellom norske isolater av Y. ruckeri serotype O1 og serotype O2, der serotype O1 (i motsetning til O2) dannet flere forskjellige klynger. Kun én slik klynge, kalt klonalkompleks 1, kan knyttes til klinisk sykdom hos norsk laks (Figur 4). Dette er meget viktig kunnskap for å kunne bekjempe yersiniose i norsk akvakultur. Vi har så langt ikke identifisert isolater tilhørende klonalkompleks 1 utenfor Norge. Videre skiller MLVA ikke bare antatt virulente og ikke-virulente lakse-assosierte bakteriestammer i Norge, men viser også at det finnes én stor internasjonal klynge (kalt klonalkompleks 2) av serotype O1 stammer fra regnbueørret (Figur 5). MLVA-resultatene viste klart hvordan denne regnbueørret-varianten har spredd seg med transport av regnbueørret fra USA til Storbritannia, Sør-Amerika og fastlands-Europa.
På verdensbasis er Y. ruckeri en svært viktig sykdomsframkallende bakterie for regnbueørret, og derfor har dette resultatet også betydelige forvaltningsmessige implikasjoner for norsk regnbueørretoppdrett. Til tross for betydelig oppdrett av regnbueørret i Norge har klinisk yersiniose, så vidt vi vet, aldri blitt påvist på denne fiskearten her til lands. MLVA-resultatene gir derfor sterke indikasjoner på at klonalkompleks 2 ikke forekommer i Norge.
Denne varianten av bakterien ble imidlertid påvist hos regnbueørret i Sverige i 2017. MLVA representerer i så måte et viktig overvåkningsverktøy for undersøkelse av eventuelle fremtidige yersiniose-utbrudd hos norsk regnbueørret. Slik overvåkning kan bidra til at en introduksjon av regnbueørret-varianten (klonalkompleks 2) fra utlandet kan oppdages på et tidlig stadium og bekjempes med målrettede tiltak.
I prosjektet ble det også påvist Y. ruckeri serotype O1 i rognvæske fra klinisk frisk stamfisk av laks. Ingen av disse isolatene falt innenfor den lakse-virulente varianten (klonalkompleks 1). Istedet fordelte isolatene seg på diverse små klonalkomplekser eller sto alene etter MLVA analyse. Disse rognisolatene, samt antatt ikke-virulente miljøisolater, er illustrert med blå ‘noder’ i Figur 4.
Undersøkelse av biofilm
Undersøkelsen av de norske ferskvannsanleggene for tilstedeværelse av Y. ruckeri viste en høy forekomst av Y. ruckeri i biofilm. Biofilmdannelse representerer en viktig overlevelsesstrategi for bakterien. Vi undersøkte derfor evnen Y. ruckeri har til å danne biofilm ved å utvikle en laboratoriebasert modell for å måle biofilmdannelse. I modellen testet vi også effekten av ulike saneringstiltak. Blant flere utprøvde medier og vannkvaliteter ble kun sjøvann identifisert som en biofilm-‘trigger’, og økende grad av biofilmdannelse ble påvist ved økende salinitet (0% - 3,5%). Bakgrunnen for dette er sannsynligvis knyttet til at bakterien oppfatter sjømiljøet som ugunstig og går over i en overlevelsesmodus. Siden feltforsøk viser at Y. ruckeri naturlig befinner seg i biofilm i ferskvannsanlegg var det overraskende å finne at kun ubetydelige mengder biofilm ble dannet i næringsfattig ferskvann. Dette kan muligens henge sammen med at laboratoriemodellen baserer seg på renkultur av Y. ruckeri, mens biofilmen i oppdrettsanleggene består av et komplekst samfunn av diverse bakterietyper. Både de norske og internasjonale stammene som ble testet viste mer eller mindre lik evne til å danne biofilm.
Resultater fra testing av tre kommersielt tilgjengelige desinfeksjonsmidler (Kickstart, DM CID, Virocid) indikerte at Y. ruckeri i biofilm ikke er særlig motstandsdyktig mot noen av disse midlene. Vi har i løpet av prosjektet fått tilbakemeldinger fra felt om at flere ferskvannsanlegg nå har klart å bli kvitt sine yersiniose-problemer ved hjelp av desinfeksjon. Testingen av desinfeksjonsmidlene viste videre at bakterien blir drept ved konsentrasjoner og eksponeringstider langt under de som er anbefalt av produsentene. Det bør imidlertid tas med i beregningen at biofilmen som ble testet i denne modellen inneholder Y. ruckeri i renkultur, noe som representerer en unaturlig situasjon. Videre er det sannsynlig at den betydelige organiske belastningen man finner i en naturlig biofilm i et oppdrettsanlegg, vil kunne redusere effekten av desinfeksjonsmiddelet.
Det nylig avsluttede prosjektet har økt kunnskapen omkring yersiniose i norsk og internasjonal akvakultur. Samtidig har prosjektet belyst et behov for ytterligere forskning på temaet og det nylig endrede kliniske bildet med økt antall utbrudd hos stor laks i sjø bringer oss nye utfordringer.
Vi vet nå at yersiniose hos norsk laks i all hovedsak forårsakes av bakterier i en svært nært beslektet undergruppe, eller klonal stamme, av Y. ruckeri serotype O1. Videre vet vi også at det i tillegg til denne virulente stammen forekommer forholdsvis mange antatt ikke-virulente varianter av Y. ruckeri. Disse forekommer hyppig i norske ferskvannsanlegg for lakseoppdrett, ofte i biofilm, men er enda ikke funnet i klinisk syk fisk. I og med at de fleste norske stammene, både virulente og antatt ikke-virulente, tilhører serotype O1, er det vanskelig å skille dem fra hverandre uten bruk av molekylærbiologiske redskaper.
Vi jobber derfor med utvikling av en målrettet qPCR for spesifikk påvisning av kun den virulente norske Y. ruckeri stammen. Forsøk med stikkvaksinering har gitt lovende resultater med hensyn til beskyttelse i sjøfasen. Likevel håper og tror vi at økt kunnskap om bakterien, smitteveier og smittedynamikk, på lengre sikt kan føre til at det ikke er behov for stikkvaksinering av norsk oppdrettslaks mot Y. ruckeri i fremtiden.
En stor takk til alle som har bidratt med kunnskap og prøveinnsamling til studiet.











