
Spironucleus salmonicida:
Fiskeparasittenes svar på
Dr. Jekyll & Mr. Hyde
En gang hvert 10. år forvandler Spironucleus salmonicida seg fra å være en veloppdragen tarmparasitt hos vill ferskvannsørret og -røye, til å bli en rovmorder som invaderer og dreper oppdrettslaks i hopetall i merder i sjøen. Sykdommen den forårsaker kalles systemisk spironukleose. I Robert Louis Stevensons berømte roman om Dr. Jekyll and Mr. Hyde, var det førstnevntes inntak av en hemmelig eliksir som forvandlet ham til den andre utgaven av seg selv – den skrekkelige morderen Mr. Hyde. I FHF-prosjektet SpiroFri har vi blant annet jaktet på den naturlige «eliksiren» som totalt endrer adferden til S. salmonicida.
Denne fagartikkelen er skrevet av:
Erik Sterud, Pure Salmon Technology; Haakon Hansen, Veterinærinstituttet; Anne Tjessem, Grieg Seafood; Ragna Heggebø, Grieg Seafood; Bjørn Olav Kvamme, Havforskningsinstituttet; Lill-Heidi Johansen, Nofima; Carlo Lazado, Nofima; Maiken Helsø, UiB; Egil Karlsbakk
Artikkelen står også på trykk i Norsk Fiskeoppdrett nr 4 2025. Last den ned som PDF her
Den angitte tiårssyklusen til sykdommen systemisk spironukleose er ikke helt nøyaktig, men utbrudd er kjent fra sjøanlegg i 1989, 2001, 2008 og 2022. Det er anslått at det siste sykdomstilfellet, som rammet en rekke sjølokaliteter i Finnmark, kostet eierselskapet nær 900 millioner i tap.
Med et viktig unntak for ett dokumentert tilfelle av sykdommen hos oppdrettsrøye i Vesterålen, kan alle tilfellene hos oppdrettslaks spores tilbake til ett og samme settefiskanlegg i Finnmark. Parasitten finnes naturlig hos ørret og røye i settefiskanleggets vannkilder, men systemisk spironukleose er aldri påvist verken hos settefisk i anlegget eller hos villfisk. Det er først etter at settefisken er overført til sjø, at parasitten gir seg til kjenne. Og da ikke som en tarmparasitt, men som frittsvømmende i fiskens blod, og årsak til sykdom bl.a. karakterisert av sviming, øyeskader, omfattende organforandringer og/eller parasittholdige byller i fiskens hud og muskulatur. Derav begrepet systemisk – «over alt».
Hvorfor og hvordan oppstår sykdommen?
Vi vet ikke! Vi kjenner ikke til parasittens smittestadium, og vi vet ikke hvilke faktorer som gjør at den forvandles fra en tilsynelatende harmløs kommensal (samboer) til en farlig parasitt. Og ikke minst hva som får den til å spre seg fra sitt antatt naturlige oppholdssted i fiskens tarm, ut i blodet og videre til alle organer i laksen. Vi kan derfor ikke si noe om ulike risikofaktorer. Alt vi vet er at det å ha vill laksefisk med disse parasittene i vannkilden til et settefiskanlegg, synes å være en forutsetning for smitte. For å forstå Spironucleus salmonicida har vi benyttet kunnskap om nærstående spironucleusarter fra andre fisk, fugler, amfibier og pattedyr – inklusive oss mennesker.
300 gåtefulle år

På midten av 1600-tallet brukte den nederlandske tøyhandleren Anton van Leeuwenhoek forstørrelsesglass for å telle trådtettheten, og dermed kvaliteten på stoffrullene han handlet med. Etter hvert syntes imidlertid Anton at det var mye morsommere å kikke på ting han samlet i naturen, enn å kjøpslå om stoffruller med gjerrige skreddere. Han videreutviklet forstørrelsesglassene til primitive mikroskoper, og med stor iver kastet han seg over studier av egne kroppsvæsker. Her fant han både røde blodceller og sædceller, og i sin egen diaré fant han det som gjorde at vi nevner ham i denne artikkelen – parasitten Giardia intestinalis. Den betydelig mer berømte slektningen til Spironucleus. Anton forsto neppe at det var Giardia som var årsaken til hans eget mageonde og diaré. Det skulle faktisk gå hele 300 år før man i 1987 (!) fikk «bevist» sammenhengen mellom Giardia og alvorlig diaré. Det er jo en slags trøst for oss som har brukt 30 år på å nøste opp i spironucleusproblematikken.
Til tross for manglende forståelse av funksjonen til alt han oppdaget, regnes Anton van Leeuwenhoek som mikrobiologiens far. Hans Giardia er primitive eukaryote organismer som senere er kjent som Diplomonada eller Diplozoa (dobbeltdyr), fordi de ser ut som to sammensmeltede individer (celler). Beslektede flagellater ble senere funnet i både råttent vann og i tarmen på dyr, inklusive fisk. I 1920 ble den første arten fra laksefisk beskrevet – Hexamita salmonis (i dag kjent som Spironucleus salmonis). Den kan gi tarmbetennelse hos oppdrettsfisk, men den har aldri forårsaket systemisk infeksjon slik vi har sett med S. salmonicida.
Slekten Spironucleus
Alle diplomonader hos fisk tilhører antakelig slekten Spironucleus.
Som sine slektninger Giardia og Hexamita, er flagellater i slekten Spironucleus «dobbeltdyr» med åtte flageller og to kjerner. Festene til de fire flagellparene sitter mellom de to sammensnodde, dreide kjernene («spiro-nucleus») i den pæreformede cellens butte, fremre ende. Tre flagellpar munner ut foran, mens det fjerde paret løper gjennom cellen, støttet av et celleskjelett, og munner ut bak, som pærens stilk.
Karakteristisk for Spironucleus er at de er rotasjonssymmetriske i lengderetningen. Parasittens åtte flagellkrefter skaper en rask, retningsbestemt og roterende fremdrift. Dette kan være interessant å tenke på i sammenheng med sykdomsutviklingen som vi skal se på senere. Spironucleus vet hvor den vil, og den kan raskt komme seg dit. Giardia har til sammenlikning en tosidig symmetri, og en tydelig ryggside og mageside. Magen har dessuten en sugeskive. Så mens Giardia er bygget for et sedat og stillesittende liv på tarmens totter, er Spironucleus bygget for fart og spenning.
Hvordan identifiseres spironucleusartene?
Med moderne utgaver av Leeuwenhoeks lysmikroskop, er Spironucleus-flagellatene lette å få øye på, der de farer hit og dit under dekkglasset som små bevegelige pærer (figur 3). Under dekkglasset blir flagellatene raskt slappe, og bevegelsene stopper opp. Da er de lette å identifisere til slekten Spironucleus ved sin typiske pæreform og 8 flageller. Hele cellen er på størrelse med en rød blodcelle. Både i nativpreparat, fargede utstryk og i vevssnitt kan man se kjernene, men ellers er det ingen detaljer som avslører hvilken art av Spironucleus man ser i lysmikroskopet. Dette er viktig å huske på når man samtidig får vite at artene S. salmonicida, S. barkhanus og S. salmonis kan være til stede samtidig i tarmen til ett og samme vertsindivid.
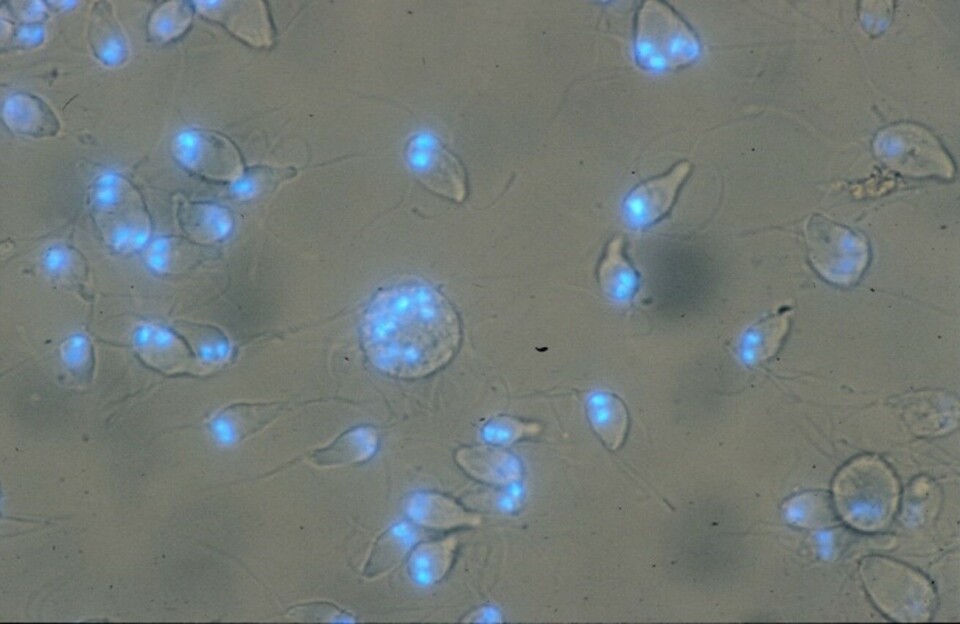
Selv om vi i 2002 beskrev retningslinjer for artsbeskrivelser av diplomonader fra fisk, basert på skanning- og transmisjonselektronmikroskopi, må vi i dag innrømme at heller ikke elektronmikroskop med skyhøy forstørrelse kan brukes for sikker artsdiagnose (figur 4). Til dette formål duger kun studier av genetiske forskjeller. SSU rRNA-genet, som koder for en del av RNA’et i cellenes ribosomer, er et populært gen å bruke til slike studier, fordi forskjellene man evt. finner her, synes å representere reelle artsforskjeller (figur 5).
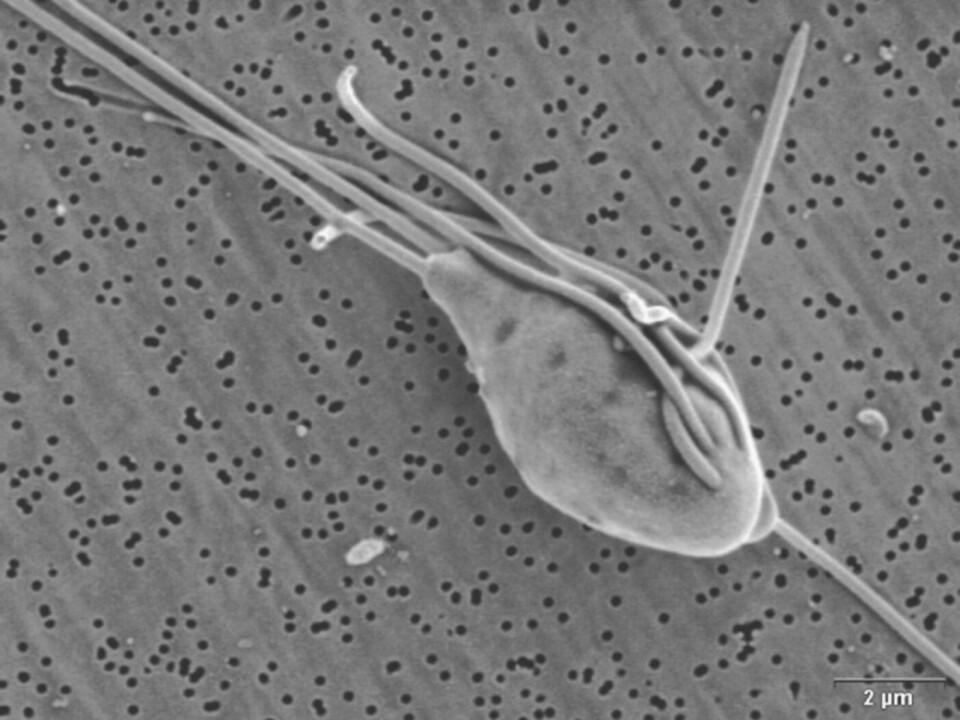

På dette punktet i historien er det greit å minne om at verken lysmikroskopet eller elektronmikroskopet har mistet sin betydning som diagnostiske hjelpemidler i parasittologien. Som parasittolog og diagnostiker gjør man det ufattelig mye lettere for seg selv ved først å lete i ferske preparater med lysmikroskopet, før vevsprøver fikseres i formalin eller andre fiksativer. Dette gjelder generelt for alle fiskeparasitter. Mikroskopene er ikke bare meget verdifulle for å finne parasitter og for å forstå oppbyggingen av dem, men de er i tillegg morsomme å bruke. Tenk så kjedelig biologien hadde vært hvis alt vi visste om Spironucleus, elefanter og snylteveps var genomenes baserekkefølge, og vi ikke kjente igjen en elefant om vi snublet over en.
Spironucleusarter hos laksefisk
Artene nevnt i figur 5, er de tre artene vi kjenner fra laksefisk. Legg merke til at alle tre artene kan forekomme i en og samme vertsfisk:
1. Spironucleus salmonis. Kjent som en tarmparasitt fra ulike laksefisk over hele den nordlige halvkule. Kan gi blødende tarmbetennelse hos sin vert.
2. Spironucleus barkhanus. Rapportert fra laksefisk i Norge og Russland, men har sannsynligvis en videre utbredelse. Den er alminnelig i vertens gallesystem, men kan også vandre til fiskens tarm. Sykdom forårsaket av S. barkhanus er ikke kjent.
3. Spironucleus salmonicida. Selve juvelen i spironucleuskronen. Den godmodige Dr. Jekyll-varianten forekommer naturlig i tarmen på ørret og røye i ferskvann, mens den systemiske, morderiske Mr. Hyde-varianten er kjent fra oppdrettslaks (både atlantisk og Chinook), oppdrettsrøye og rognkjeks. Hos sistnevnte art er de kun funnet hos individer som tjenestegjør som rensefisk i merder med laks med S. salmonicida.
Andre spironucleusarter, verter og vertspreferanser
Basert på molekylær identifikasjon av norske funn, kjenner vi også Spironucleus torosus fra en lang rekke torskefisk, inkludert ferskvannsfisken lake (figur 6). I tillegg har vi funnet den vakkert ornamenterte Spironucleus vortens i karpefisken vederbuk (figur 7), samt ukjente spironucleusarter i både sandflyndre og gapeflyndre (figur 8).
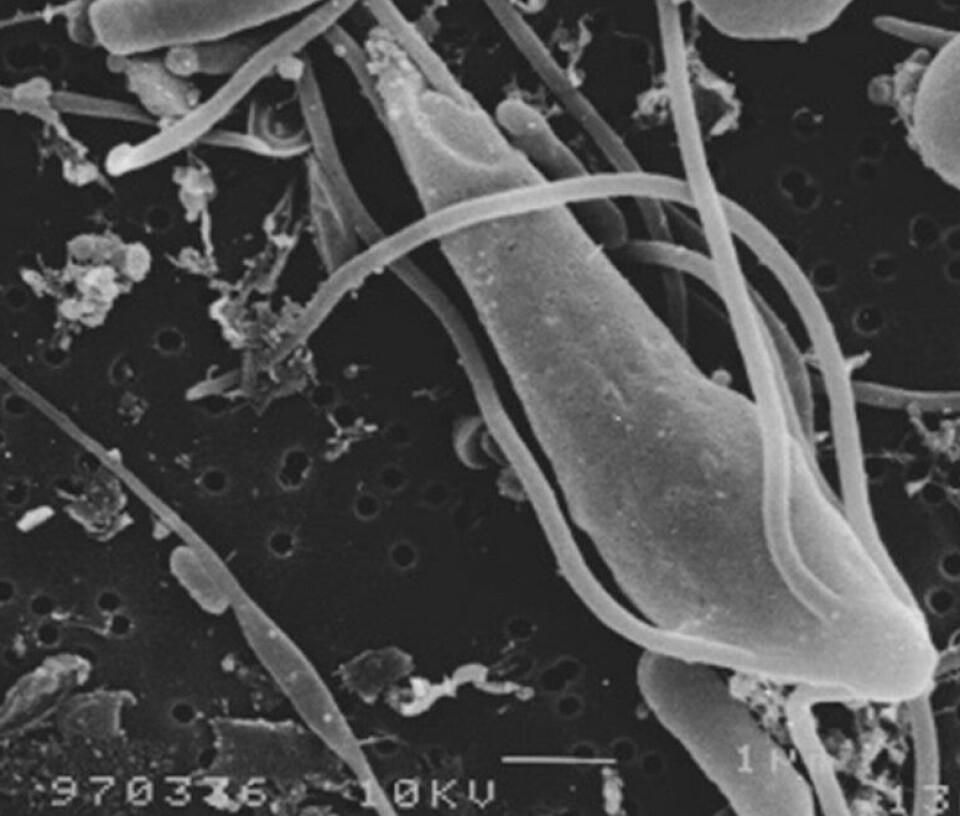

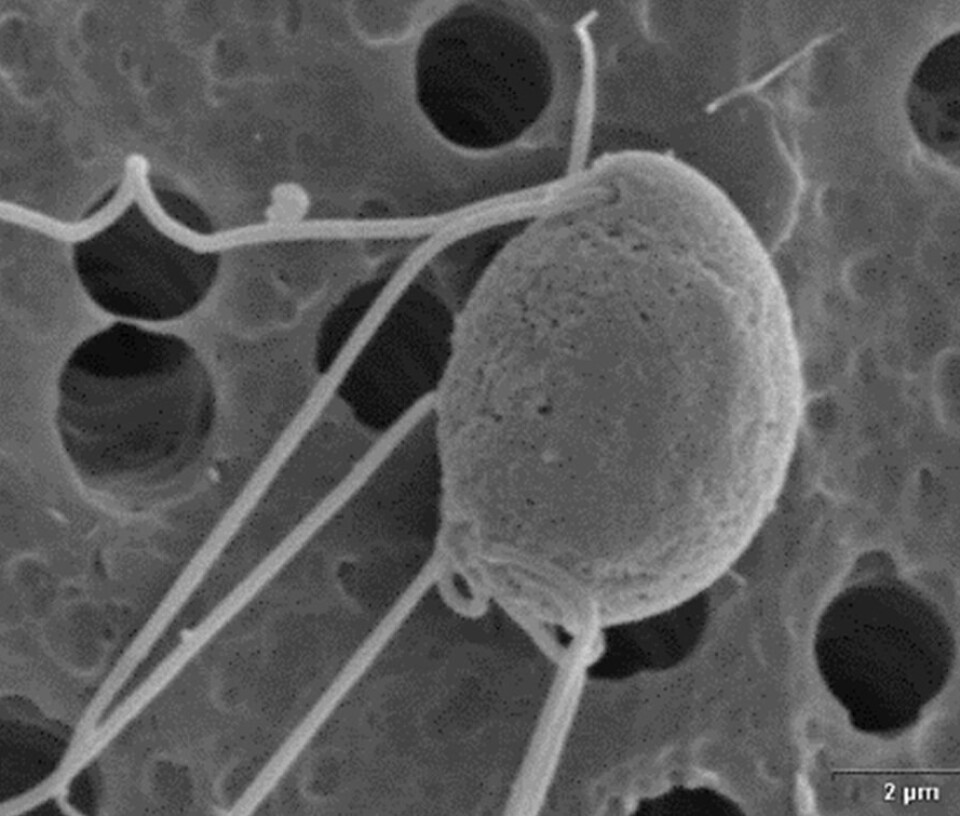
Sykdommen systemisk spironukleose hos laks
I 1989 ble det for første gang observert en ny sykdom på oppdrettslaks i merder i Finnmark. I illeluktende byller i lever, nyre, hud og andre organer, ble det funnet store mengder spironucleus-flagellater. Kunnskapen om dem var liten, og man mistenkte både Spironucleus salmonis og Spironucleus barkhanus, før molekylærbiologen og doktorgradsstudenten Anders Jørgensen, etter utbruddet i 2001, forsto at dette var en helt ny art. Han beskrev arten og kalte den Spironucleus salmonicida – laksedreperen.
Etter ytterligere et sykdomsutbrudd, ble parasitten i 2010 påvist hos røye og ørret i settefiskanleggets vannkilder. Faktisk også sammen med de ufarlige artene S. salmonis og S. barkhanus. Det er lov å både undres og gledes over hvordan evolusjonen har klart å ta frem tre distinkte arter i samme vertsfisk i samme vann.
Så var det på’an igjen
Som etter utbruddene både i 1989 og 2001, gikk parasitten i glemmeboka også etter 2008-utbruddet. Men så, uten forvarsel, dukket sykdommen opp for fjerde gang i Finnmark i 2022. Nok en gang på en rekke sjølokaliteter som alle hadde fått fisk fra det samme settefiskanlegget som ved tidligere utbrudd hos laks.
På et tiår i oppdrettsindustrien vokser alt. Også konsekvensene av et alvorlig sykdomsutbrudd. Og med parasitter som forårsaker tap i milliardklassen hadde plutselig nerdete parasittologer, oppdrettsfirmaer og finansieringsinstitusjoner sammenfallende interesser. Prosjektet SpiroFri, (Spironucleus salmonicida-infeksjoner og Spironucleus i norsk akvakultur: Smitteveier, vertsspekter og forebygging – SpiroFri) som du nå skal få høre litt mer om, ble startet opp av Fiskeri- og havbruksnæringens forskningsfinansiering FHF i 2023. En nærmere beskrivelse av dette prosjektet er å finne på: https://www.fhf.no/prosjekter/prosjektbasen/901831
I hovedsak ville vi få frem kunnskap for forebygging og bekjempelse av S. salmonicida.
Nedenfor følger en beskrivelse av nye observasjoner gjort under det siste utbruddet, samt sentrale resultater fra forskningsprosjektet.
Hvordan smitter flagellatene?
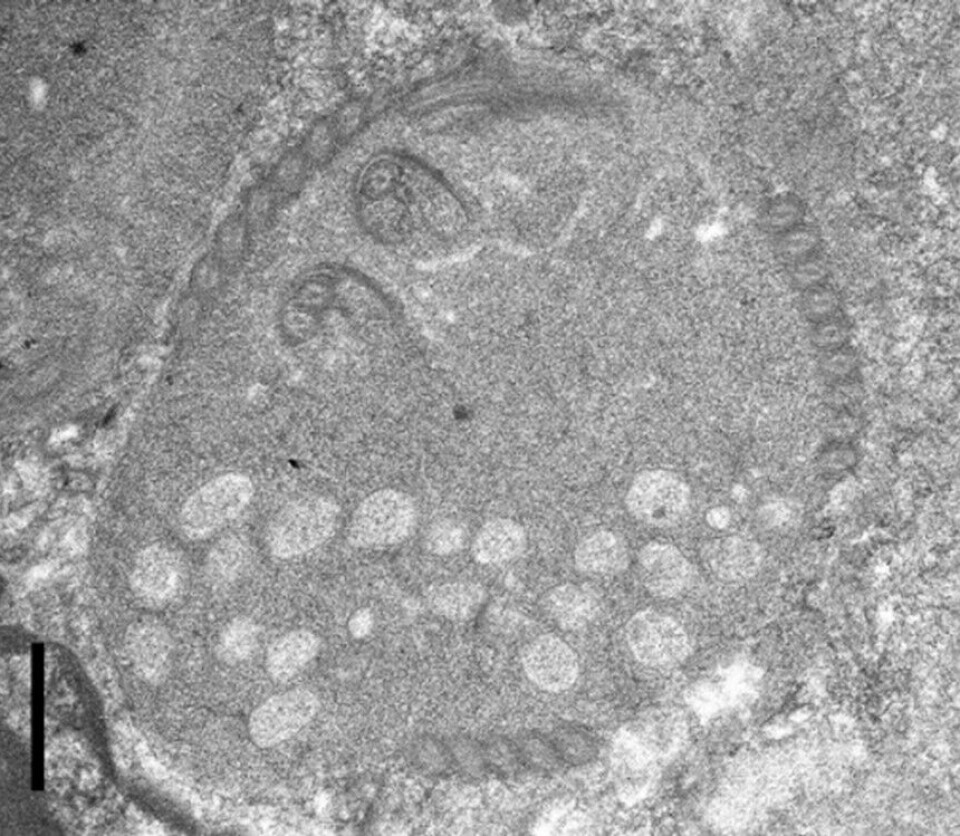
Basert på kunnskap fra andre spironucleusarter, antar vi at den normale smitteveien for S. salmonicida er inntak av infektive cyster (innelukkede individer) som spres i vannet. Andre forskere har påvist at også S. salmonicida har gener som koder for cysteveggproteiner, men ingen har noensinne sett cyster av S. salmonicida – kun cysteliknende strukturer i kulturer av parasitten. Figur 9 viser et snitt av en S. salmonicida fra sjørøye. Man ser tverrsnitt av mange flageller liggende som små ringer rundt cellekroppen. Med ikke altfor mye fantasi ser man lett likheten med den runde cellen nederst på Figur 10. Det viser et individ av Spironucleus torosus i ferd med å encystere seg. En frittsvømmende S. torosus-flagellat, en såkalt trofozoitt, ses ved siden av.
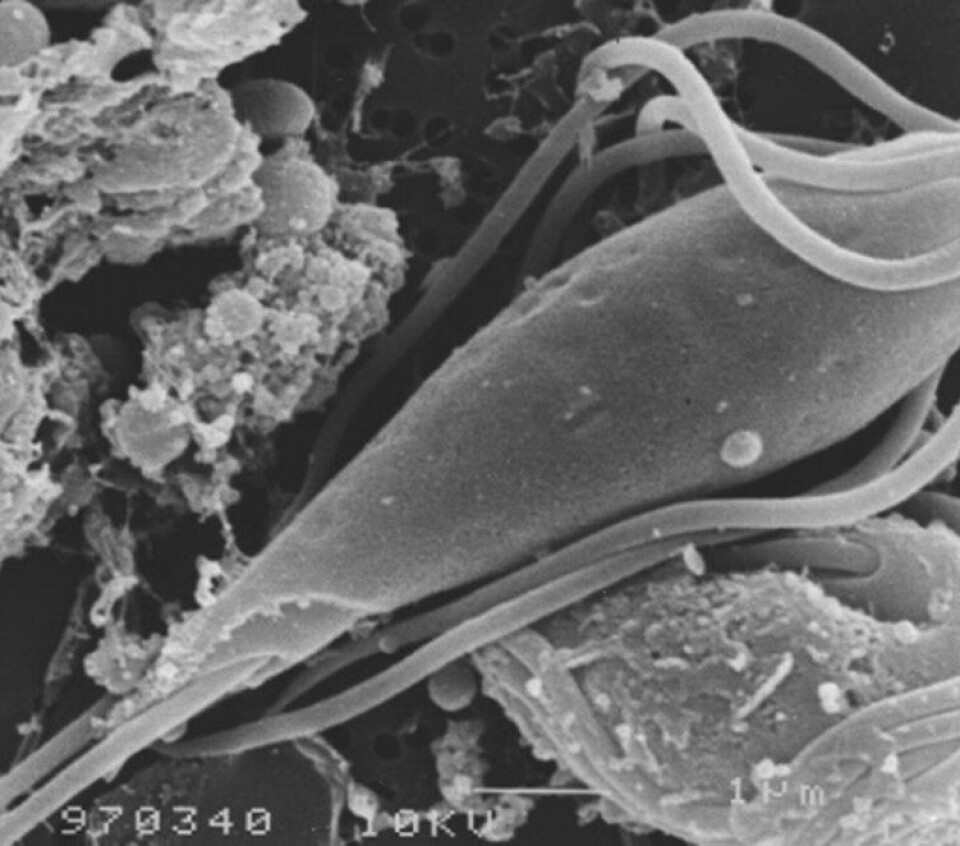
I mangel av et endelig bevis for cystedannelse i S. salmonicida spurte vi oss om parasitten kan smitte også som frittsvømmende flagellater (trofozoitter) i vann. Gjennom SpiroFri-prosjektet er vi nå helt sikre på at dette er mulig. Følgende forsøk viser dette:
1. I prosjektet har vi gjennomført mange vellykkede smitteoverføringer i sjøvann fra badsmitte, samt fra infiserte laksefisk over til uinfiserte laksefisk og rognkjeks som har gått i samme kar.
2. I sin masteroppgave gjort under SpiroFri-prosjektet, fant Maiken Helsø ut at overlevelsen til S. salmonicida-flagellater i rent sjøvann er akkurat lang nok til at trofozoitter kan være et effektivt smittestadium innenfor eller mellom oppdrettsmerder på samme lokalitet (se Tabell 1). Men resultatene hennes sannsynliggjør også at frie flagellater ikke er hovedsmittekilden inn til settefiskanlegget, og at de heller ikke kan smitte over lengre avstand i sjø.
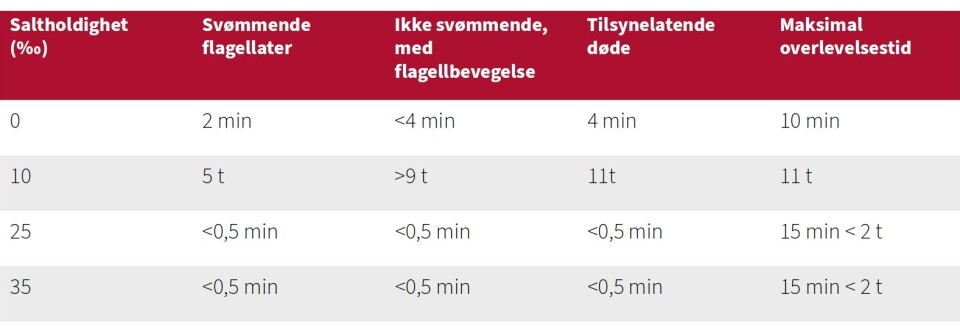
* Oppsummert fra Maiken Helsøs MSc-oppgave, Univ. Bergen 2024 (https://hdl.handle.net/11250/3163952)
Smittespredning
Ett av anleggene som opplevde det aller første utbruddet (1989/90) hadde ikke fått fisk fra samme settefiskanlegg som de andre matfiskanleggene, men det lå mindre enn 100 meter unna et slakteri der fisk med systemisk spironukleose ble slaktet. Blod og prosessvann herfra gikk ubehandlet rett i sjøen, slik man gjorde den gang, og forskerne som fant parasitten antok derfor horisontal smitte fra slakteriet. Påvisning av systemisk spironukleose også hos rognkjeks i forbindelse med det siste utbruddet, og vellykket smitte av både rognkjeks og laks i SpiroFri-prosjektet, har bekreftet at horisontal smitte i sjø er mulig. Spørsmålet er hvilken praktisk betydning dette har.
Vi regner med at horisontal smitte også er vanlig for smolten som settes i sjøen. Men kun over korte avstander, basert på parasittens korte overlevelsesevne i sjøvann. Spredning fra fisk til fisk i samme merd er helt klart mulig. Også mellom merder ved gunstig strøm, men ikke mellom lokaliteter med dagens lokalitetsstruktur.
Når det gjelder rognkjeksen så antar vi at de har blitt utsatt for et svært stort smittepress av en parasitt de aldri vil treffe på i naturen, og videre at rognkjeks ikke representerer en vektor som har betydning for spredning av Spironucleus salmonicida i sjø.
Det er viktig å påpeke her at settefiskprodusenten aldri har satt ut fisk som de visste var positive for S. salmonicida. Parasitten har heller aldri blitt påvist ved rutinescreening i settefiskanlegget. Hvor stor andel av settefisken som var infisert ved sjøsetting aner vi ikke. Bortsett fra at andelen (prevalensen) må ha vært høy nok til at alle rammede sjølokaliteter har mottatt infisert fisk. Samtidig var det ved siste utbrudd nokså stor variasjon i sykdomsbildet mellom merder og mellom lokaliteter. Dette antyder at prevalensen, og dermed smittepresset på uinfisert fisk, stedvis har vært lavt.
Systemiske infeksjoner – spredning ut av tarmen
Systemisk spironukleose er karakterisert av at parasittene ikke bare har infisert oppdrettslaksen og rognkjeksen, men også forekommer i blod og vev. Hvorfor og hvordan er fremdeles en gåte.
Det vi kan konkludere med er at parasittene går fra en «tarmfase», via en «blodfase» før de til slutt ender i en «vevsfase». I denne vevsfasen begrenses parasittene til lommer (ofte «byller») med flagellater i muskel, hud, lever, nyre, bak øynene eller i væsken rundt hjertet og hjernen. Det kan synes som om parasitten har en forkjærlighet for muskler og hud i haleregionen til oppdrettslaks.
I smitteforsøk fikk vi ikke smittet all forsøksfisken, og ikke all forsøksfisken som ble infisert utviklet systemisk spironukleose. I smitteforsøk brukte vi «Mr. Hyde-varianten» av S. salmonicida isolert fra syk laks. Det ville vært spennende å gjennomføre smitteforsøk med en naturlig tarmvariant av S. salmonicida, hentet fra vill ørret og røye, der parasitten opptrer som en kommensal? Altså Dr. Jekyll-varianten. Ville resultatene blitt de samme?
Som veterinærmedisinske fagfolk kanskje allerede har forstått, så har vi ikke noe bevis for at det faktisk finnes to reelle varianter av parasitten. Miljøforandringer, stress og nedsatt immunforsvar hos fisken i forbindelse med sjøsetting er sannsynligvis den viktigste utløsende faktor for utvikling av systemisk spironukleose. Dette forklarer imidlertid ikke hvordan og hvorfor settefisken så sjelden blir infisert. Det forklarer heller ikke hvorfor parasitten «velger» å vandre fra oppdrettsfiskens tarm og ut i fiskens blod og vev. Det faktum at sykdommen kun er påvist noen få ganger med ca. 10 års mellomrom, antyder at det også kan være forbigående faktorer utenfor fisken (i miljøet eller hos parasitten) som spiller en avgjørende rolle for smitteoverføring fra villfisk til settefisk i anlegget, og deretter for utvikling av sykdom når denne fisken settes i sjøen.
Også hos andre arter
Det hører med til historien at systemiske infeksjoner med diplomonader slett ikke er ukjent. Det har vært sett systemiske infeksjoner med S. anguillae hos ål, S. vortens i barber og S. elegans hos ulike akvariefisk. Såkalt Hole-in-the-head-disease er en velkjent sykdom forårsaket av sistnevnte.
Det har også vært sett systemisk infeksjon med en ukjent art Spironucleus, hos makaker (aper) med immunsvikt, så evnen til å krysse vevs- og epitelbarrierer synes å være en iboende egenskap hos disse organismene.
Forebygging
Om vi et øyeblikk returnerer til Anton van Leeuwenhoek, så ledet hans oppdagelser av sædceller etter hvert til at Louis Pasteur kunne avlive myten om at levende organismer kan spontangenerere. Det er nyttig kunnskap fremdeles. Alle parasitter hos oppdrettslaks kommer fra en ekstern kilde, selv om vi ikke alltid vet hvordan. I tilfellet Spironucleus salmonicida, er det vill ørret og røye i vannkilden til settefiskanlegget man skal være redd for. I prosjektet sjekket vi derfor om en UV-behandling tar livet av parasittene. Det gjør den! Basert på labforsøk med frittsvømmende flagellater og ulike typer UV-lamper og strålingsdoser, anbefaler vi at man benytter såkalte mediumstrykks UV-lamper fremfor lavtrykkslamper, og benytter doser som er minst dobbelt så høye (50 mJ/cm²) som myndighetenes anbefalte minimumsdose for UV-behandling av inntaksvann til settefiskanlegg. Den anbefalte dosen må justeres opp dersom vannet har lav UV-transmisjon/høy organisk belastning. Husk at dette kan variere gjennom året. Men hva med effekt av UV på eventuelle cyster vil noen kanskje spørre. Et godt poeng, siden vi jo tror at cyster et det vanlige smittestadium inn i et settefiskanlegg. Igjen må vi støtte oss på kunnskap om Giardia, og flere forskere har vist at cyster av denne arten heldigvis er mer følsomme for UV-stråler enn trofozoittene. Det er ikke urimelig å anta at det samme gjelder S. salmonicida.
Oppsummering ved reisens slutt
Det femte dokumenterte utbruddet av systemisk spironukleose hos norsk oppdrettsfisk er nå historie, og forskningsprosjektet SpiroFri nærmer seg også slutten. Vi har lært mye nytt. Både fra sykdomsutbruddet, med påvisning av parasitten hos rognkjeks, og fra de forskjellige arbeidspakkene i forskningsprosjektet.
Noe av det vi sitter igjen med, er faktisk spørsmål om hvorfor systemisk spironukleose ikke ses oftere hos norsk oppdrettsfisk. Vi antar at Spironucleus salmonicida er langt mer vanlig nordpå enn det vi har bevis for. Og all den tid dens naturlige verter stedvis også er anadrome, kan man i teorien tenke seg langt flere mulige kontaktpunkter mot oppdrettsfisk enn det antall kjente sykdomstilfeller skulle tilsi. Men slik er fiskeparasittenes underfundige verden. De finnes i flere av faunaens riker og rekker, og gjennom deres lange evolusjonære samliv med en vert, har det oppstått forhold som slett ikke alltid er intuitivt forståelige. Et godt eksempel er typisk nok forholdet mellom slekten Spironucleus og laksefiskene våre. Hvilke evolusjonære drivere som har ført til dannelsen av de tre artene S. salmonis, S. barkhanus og S. salmonicida, med svært varierende dødelige potensial, er uforståelig fascinerende.
Vi har fått bedre kunnskap om frie spiroflagellaters overlevelsesevne i vann. Den er svært dårlig, men allikevel tilstrekkelige til at trofozoittstadiet kan være et effektivt smittestadium under oppdrettsbetingelser. Heldigvis har vi også fått kunnskap om at UV-bestråling av inntaksvann til settefiskanlegg vil kunne være en effektiv forebyggende behandling, og dette er allerede tatt i bruk av det aktuelle settefiskanlegget.
Vi mener på generelt grunnlag at alle settefiskanlegg burde gjennomføre en parasittundersøkelse av fisk i vannkilden. Gjennom prosjektet har vi utviklet sensitive og presise genteknologiske metoder for å påvise S. salmonicida. Tilsvarende finnes også for andre parasitter, men et hjertesukk til slutt må være at veterinærer og biologer aldri glemmer hva Anton van Leeuwenhoek lærte oss om lysmikroskopets betydning for mikrobiologien.











