Nytt lusemiddel med markedsføringstillatelse
Benchmark har fått markedsføringstillatelse fra Legemiddelverket for sitt nye lusemiddel Ectosan (BMK08).
Denne artikkelen er tre år eller eldre.
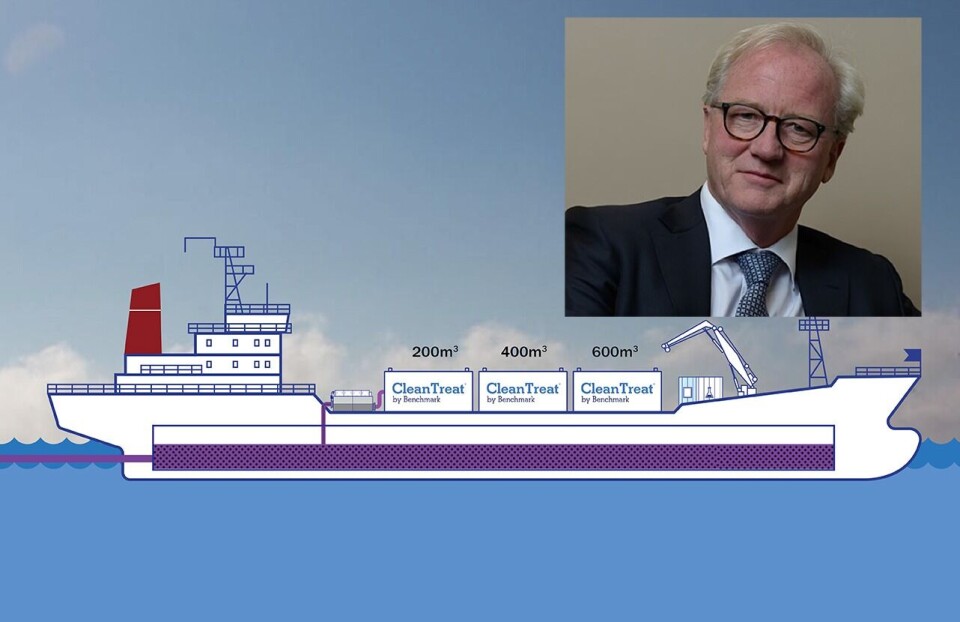
Ectosan er dermed den første veterinærmedisinske behandlingen med lakselus som er introdusert til det norske laksemarkedet på over et tiår. Legemiddelet er basert på neonikotinoidet imidacloprid og skal benyttes sammen med rensesystemet CleanTreat
Benchmark inngikk sine første kundeavtaler for rensesystemet CleanTreat i mars 2021 og har nå infrastrukturen og operasjonelle evner på plass for å starte levering av sin luseløsning, , når de siste trinnene er fullført i de kommende ukene.
- Basert på markedsføringstillatelsen forventes Ectosan Vet og CleanTreat å være lønnsomme fra begynnelsen. Som tidligere kommunisert vil den første lanseringen være med to fartøy.
Ennå skjær i sjøen
De siste trinnene for kommersialisering er ratifiseringen av MRL (Maximum Residue Limit) i norsk regelverk og godkjenningen av produktmerker fra Legemiddelverket .
- MRL-ratifiseringen i norsk forskrift er et prosedyretrinn etter EU-lovgivningen og forventes fullført i løpet av de neste ukene, skriver Benchmark i en pressemelding.
Imidlertid vedtok EU-parlamentet for et par uker siden en resolusjon (B9-0313 / 2021) som motsetter seg maksimal restgrense (MRL) for imidakloprid på fisk. Hvordan denne vil slå ut er ikke helt avklart ennå.
MRL ble i utgangspunktet ratifisert som europeisk lov gjennom en EU-kommisjonens gjennomføringsforordning 15. april 2021.
Benchmark forklarer i pressemeldingen at EU-kommisjonens beslutning ble tatt etter et grundig studieprogram som bekreftet sikkerheten til BMK08 (imidacloprid), og en grundig vurdering av solide vitenskapelig bevis fra European Medicines Agency Committee for Veterinary Medicinal Products, 9. september 2020. Deretter anbefalte kommisjonen 26. februar 2021 at det ble etablert en maksimal restgrense i fisk. Denne anbefalingen ble bekreftet 20. mars 2021 av Kommisjonens faste komité for veterinærpreparater og vedtatt av EU-kommisjonen 15. april 2021.
- Selskapet har full tillit til Det europeiske legemiddelkontoret og EU-kommisjonens vitenskapelige og regulatoriske prosess, skriver de.
Selskapet overvåker eventuelle ytterligere beslutninger Kommisjonen måtte ta eller ikke kan ta etter vedtakelsen av resolusjonen, og vil oppdatere markedet på det tidspunktet.
Fornøyd
Administrerende direktør i Benchmark Trond Williksen, er naturlig nok fornøyd.
- Vi er glade for å ha mottatt markedsføringstillatelse fra Statens legemiddelverk, som representerer en viktig milepæl for selskapet. Det er vitnesbyrd om forskerteamet ved Benchmark at vi er i stand til å bringe den første nye veterinærmedisinske behandlingen til lakselus til den norkse oppdrettsnæringen på over et tiår.
Han kaller løsningen sår tiltrengt, som en driver for bærekraft gjennom forbedret dyrevelferd og avling samtidig som vi beskytter miljøet.











